Becken Desinfektion
Becken Chloerung
H2O + Cl2 > HCl + HClO
Wasser + Chlorgas > Salzsäure + unterchlorige Säure
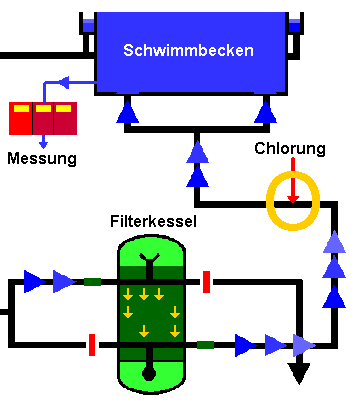
Zugelassene Desinfektionsmittel
Nach der DIN 19643 T1 sind folgende Stoffe zur Beckenwasserdesinfektion zugelassen
Chlorgas
– Cl2
– nach E DIN EN 937 in Druckbehälten abgefüllt
– oder durch Herstellung via Elektrolyse am Herstellungsort
Natriumhypochlorid Lösung
– NaClO
– nach E DIN EN 901
– oder durch Herstellung via Elektrolyse am Herstellungsort
Chlor
– abtöten von Bakterien, Keime, Pilze
– in höheren Konzentrationen giftig bis tödlich
– freier wirksamer Chlor nach DIN 19643
min 0,3 mg/l
max 0,6 mg/l
– Warmsprudelbecken nach DIN 19643 (Vermehrung der Bakterien/Pilze mit Temperaturerhöhung)
min 0,7 mg/l
max 1,0 mg/l
– Es entsteht Salzsäure (desinfizierend; stark PH-Wert senkend daher unerwünscht) und die für die Desinfektion
erwünschte unterchlorigen Säure (HClO). Diese dissoziiert (je alkalischer das Wasser, desto stärker) teilweise
zu Hypochlorit (H+ + ClO-), welches eine nicht so gute Desinfektionseigenschaft besitzet. Das
Verhältnis zwischen Salzsäure, unterchloriger Säure und Hypochlorit hängt vom PH-Wert ab. Je
alkalischer das Wasser, desto mehr unterchlorige Säure wird neutralisiert (Hypochlorit Ionen entstehen)
– die Beckendesinfektionswirkung sinkt mit zunehmendem PH-Wert
Chlorzehrung
– Verschmutzungsgrad des Wassers
– Sonneneinstrahlung
– Frequentierung (Besucherzahlen)
– höhere Temperatur begünstikte Keimvermehrung
– ausgasung mit Temperaturerhöung
– dissoziationsgrad der unterchlorigen Säure steigt mit zunehmender Temperatur
– Freibäder haben aufgrund von erhöter Verschmutzung und Sonneneinstrahlung eine höhere
– bei Längsdurchströmung muß stärker gechlort werden, wie bei Querdurchströmung
Gebundenes Chlor / Chloramine
Die unterchloriege Säure reagiert mit kolloied dispersen Stoffen (Schweiß, Urin), welche Stickstoffhaltig sind zu Chloramine. Diese haben noch eine schwach desinfizierende Wirkung und werden als gebundenes, wirsames Chlor bezeichnet.
– gebundener Chlor = Stickstoffhaltige Verbindung der unterchlorigen Säure (Chloramine)
– NH3 + HClO > NH2Cl + H2O
– Ammoniak + unterchlorige Säure > Monochloramin + Wasser
– typischer Hallenbadgeruch
– verandwortlich für Augen- und Schleimhautreizungen des Nasen- und Rachenraumes
– max 0,2 mg/l nach DIN 19643
Verminderung des gebundenen Chlors
Frischwasserzufuhr
– oft zu teuer
Aktivkohlefilter
– absorbiert Chloramine
Stoßchlorung
– freies Chlor kann gebundenes Chlor abbauen
THM (Trihalogenmethane)
Neben den Chloraminen entstehen bei Reaktion mit im Beckenwasser vorhandenen organischen Stoffen auch Trihalogenmethane (THM) bei Desinfektion mit Brom. Trihalogenmethane sind in größeren Mengen eingeatmet krebserregend.
Hierzulande entstehen Trichlormethan (Chloroform) da Brom zur Beckendesinfektion nicht zugelassen ist. Der Chloroform gehalt eines Bades ist 20 200 mal höher als in der Normalen Außenluft, jedoch noch lange nicht toxisch. Langzeitauswirkungen auf den Menschen sind noch ungeprüft.
– THM in größeren Mengen krebserregent
– CHCl3 Trichlormethan (Chloroform) Gesundheitsschädigung ungeprüft
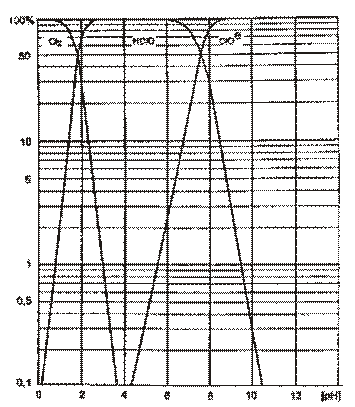
Verteilung der Chloranteile
im Zusammenhang mit dem PH-Wert
PH HOCl ClO-
6,5 90% 10%
7,0 75% 25%
7,5 50% 50%
7,6 40% 60%
7,8 30% 70%
Alternative Chlorungsvarianten
Natriumhypochlorit (NaClO/Chlor-/Natronbleichlauge)
Chlorbleichlauge wird in Wasser eingeleitet. Es entsteht unterchlorige Säure und Natronlauge. Da OH–Ionen im Überschuss vorliegen hat das Natriumhypochlorit PH-Wert hebende Wirkung.
– NaClO + H2O > Na+ + OH- + HClO
– Natriumhypochlorit + Wasser > Natronlauge + unterchlorige Säure
– flüssig
– OH–Ionen im Überschuss
– PH-Wert hebend
– geringer Aktivkohlegehalt (~15%)
Calciumhypochlorit
Calciumhypochlorit wird in Wasser eingeleitet. Kalkwasser und unterchlorige Säure entsteht. Da OH–Ionen im Überschuss vorliegen hat das Calciumhypochlorit PH-Wert hebende Wirkung.
– Ca(ClO)2 + 2 H2O > Ca2+ + 2 OH- + 2 HClO
– Calciumhypochlorit + Wasser > Kalkwasser + unterchlorige Säure
– Granulat
– OH–Ionen im Überschuss
– PH-Wert hebend
– begünstigt Kalkausfällung
Chlorsättigungskurve
Chlor hat wie alle anderen Stoffe auch verschiedene Aggregatzustände. Diese können sich nicht nur durch Temperaturänderung, sondern auch durch Druckänderung verändert werden.
Deffinition
In der Chlorsättigungskurve kann abgelesen werden bei welchem Druck / Temperatur Verhältniß das Chlor die Aggregatzustände zwischen flüssig und gasförmig wechselt.
Temperaturkonstant
Bei gleichbleibender Temperatur wechselt das Chlor durch Druckanstieg vom gasförmigen ins flüssige.
Beispiel bei 20°C:
5 bar = gasförmig
8 bar = flüssig
7 bar = umschlag von gasförmig zu flüssig
Bei gleichbleibenden 20°C ist bis zu einem Druck von 7 bar gasförmig. Steigert man den Druck auf über 7 bar, so wird das Chlor flüssig.
Druckkonstant
Bei gleichbleibendem Druck wechselt das Chlor durch Temperatursteigerung vom gasförmigen zum flüssigen.
Beispiel bei 9,5 bar:
10°C = gasförmig
35°C = flüssig
33°C = umschlag von gasförmig zu flüssig
Bei gleichbleibendem Druck von 9,5 bar ist bis zu einer Temperatur von 33°C das Chlor gasförmig. Bei Steigerung der Temperatur wird das Chlor flüssig.