PH-Wert
Deffinition PH
Deffinition
potentia hydrgenii (lat.) = Kraft (p) des Wasserstoffs (H)
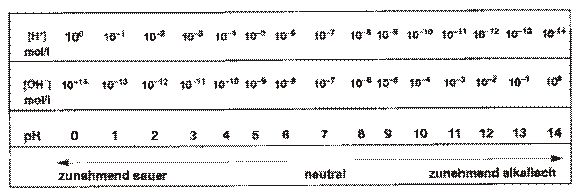
Der PH-Wert trifft eine Aussage über den Säurewert des Wassers. Der PH-Wert ist der negative dekadische Logarithmus der in mol/l angegebenen H+-Ionenkonzentration.
Der PH-Wert gibt die H+ Konzentration an und wird in mol/l angegeben. Er ist die negatiive Hochzahl (zur Bassis 10) der H+Ionenkonzentration. Erhöt sich der PH-Wert um 1, so multipliziert sich die H+ Konzentration um 10. Je höher der PH-Wert, umso niedriger ist die H+-Ionen-Konzentration, desto alkalischer ist die Lösung. Wenn gleichviele H+ und OH- Ionen vorliegen ist die Lösung neutral. Das Verhältnis zwischen H+ und OH- Ionen bleibt immer gleich (die Hochzahl addiert ergibt 14).
Für die Hydroniumkonzentration H2O+ wurde in der Chemie eine Maßzahl eingeführt, die als Potnzia
Hydrogeni, der PH-Wert angegeben wird. Der PH-Wert wird definiert als der negativ dekadische
Logarithmus der Ionenkonzentration. Somit erhalten wir einen einfachen Zahlenwert.
Räumliche Anordnung eines Wassermoleküls
O = Sauerstoff
H = Wasserstoff
H2O = Wasser, asymetrisch gelagert 2
Dipol durch Ladungsverschiebung
Durch die nicht symetrische Lagerung der Elektronen ist das Wasserstoffmolekühl einseitig positiv, auf der anderen Seite negativ geladen.
Wenn in einer Lösung positive Hydroniumionen überwiegen können positive Ladungsträger (Protonen) abgegeben werden.
Ionenverbindung
– Aufspaltung einzelner Bestandteile ohne Austausch von Elektronen
– Beispiel:
OH- + HO+ 3
Hydroxion OH-
Hydromiumion H O+ 3
OH- gibt H Atom an H O+ ab 3 abgegebenes Proton ist in wässriger Lösung nicht existensfähig
PH Wert definition
– Konzentration freier Ionen in einem Liter Wasser
– 1 mol ~ 18g
– 22°C = 10-7 mol H3O+ und 10-7 mol OH-
d.h. in 10.000.000 Liter Wasser sind 1mol H3O + PH neutrales Wasser
– Hydroniumionen = 1 * 10-7 mol/l > PH 7
PH verschiebung in Richtung Sauer
– Hydroniumionen = 1 * 10-6 mol/l > PH 6
Information PH
Maßeinheit
[H+] = 10² mol/l = PH 2
[H+] = 10³ mol/l = PH 3 etc.
Der PH-Wert wird in mol/l angegeben.
H+ = 1mol = 1g
OH- = 1mol = 17g
PH-Bereiche
Der PH-Wert sollte möglichst neutral (pH 7) gehalten werden.
Allgemein
– unter pH 7,0 = sauer (überwiegender H+-Ionenanteil)
– pH 7,0 = neutral (gleichviele H+ und OH- Ionen)
– über pH 7,0 = alkalisch (überwiegender OHIonenanteil)
Süßwasser
– pH 6,5 bis pH 7,6
Meerwasser
– pH 6,5 bis pH 7,8
PH Werte Beckenwasser
– Minimum 6,5
– Maximum Süßwasser 7,6
– Maximum Meereswasser 7,6
PH Wert Einordnung
– 0 – 3 = stark sauer
– 3 – 7 = schwach sauer
– 7 -11 = schwach alkalisch (basisch)
-11-14 = stark alkalisch
PH-Wert der Haut
Der PH-Wert der menschlichen Haut liegt um 5.
Lange Zeit galt als Normal-PH-Wert der Haut ein Bereich von 5,4–5,9. Aktuelle Studien haben jedoch gezeigt, dass der physiologische pH-Wert knapp unter 5 liegt. Der PH-Wert wird von vielen Faktoren beeinflußt wie z.B. Alter, Geschlecht, Hautareal, etc.
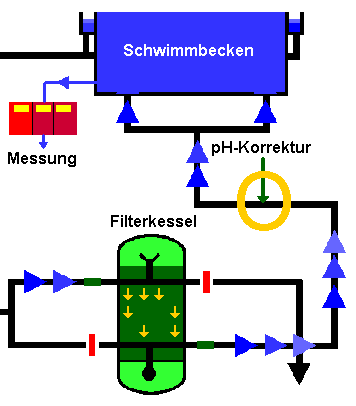
 Die sorgfältige Einhaltung des pH-Wertes des Beckenwassers im Bereich 6,5-7,6 ist unerläßlich, um einerseits die verschiedenen Aufbereitungsmaßnahmen
Die sorgfältige Einhaltung des pH-Wertes des Beckenwassers im Bereich 6,5-7,6 ist unerläßlich, um einerseits die verschiedenen Aufbereitungsmaßnahmen
optimal durchführen zu können und andererseits das
Wohlbefinden der Badenden nicht zu beeinträchtigen.
Weiterhin gilt es, pH-bedingte Korrosionen und
Kalkabscheidungen zu vermeiden. Die Zusammenhänge
erläutert die Grafik.
Generell kann gesagt werden, daß Wasser mit einer
Säurekapazität von 0,7 mol/m³, also ab einer
Hydrogen-Karbonathärte von ~ 2 dH über eine
ausreichende Pufferkapazität verfügt, um pH-Wert
hebende oder senkende Einflüsse durch
Flockungs- und Desinfektionsmittelzusätze
aufzufangen, eine normale Betriebsweise und
täglicher Füllwasserzusatz gemäß DIN 19 643
(mindestens 30 Liter pro Badegast und Tag)
vorausgesetzt.
PH-Wertverschiebung
Ursachen
– Füllwasser (für gewöhnlich nicht neutral)
– Dolomitfilter erhöhen den pH-Wert (besteht aus Calciumcarbonat und Magnesiumoxid)
– Flockung
– Auf- und Enthärtung
– Regenwasser (geringfügig, da nur wenig Regenwasser im Verhältniß des gesamten)
– Temperatur (CO2, Cl2 gasen mit Temperaturerhöung aus, Wasser wird alkalischer)
– Überdosierung Beckendesinfektion (bei der Chlorung entsteht Säure)
– verbrauchter Marmorkies (fehlende Wirkung)
– unvorsichtige pH-Korrektur Dosierung (besonders empfindlich im neutralbereich)
zu niedriger PH-Wert (pH <6,5)
– Korrision von Metallen (Rohrleitungen, Armaturen)
– Zerstörung kalkhaltiger Baustoffe (Fugen)
– Störung der Flockung (Aluminiumhydroxid reagiert mit H+ zu gut löslichen Aluminiumionen)
– Chloramin Bildung (unterchlorige Säure u. Ammoniak des Urins reagieren typischer Hallenbadgeruch)
zu hoher PH-Wert (pH >7,6/>7,8)
– verminderte Desinfektionswirkung (Dissoziation der unterchlorigen Säure steigert sich mit dem PH-Wert)
– Zerstörung des Säuremantels (neutralisiert Säureschutzmantel, erhöte Angriffsmöglichkeit für Erreger)
– verminderte Flockungswirkung (Aluminiumhydroxid reagiert mit OH- zu gut löslichen Aluminationen)
– erhöhte Kalkabscheidung (trübt Beckenwasser, Kalkablagerungen)
PH-Wertkorrektur
Ist der PH-Wert zu niedrig, muß Lauge zugeführt werden. Ist der pH-Wert zu hoch, muß Säure beigemengt werden. Es entstehen aufgrund der Neutralisation Aussalzungen bei der PH-Wert korrektur, daher sollte ebenfalls Frischwasser zugeführt werden. Die Konzentration ist zu beachten (bei 10%iger 3 mal so viel verwenden, wie bei 30%iger). Gemäß DIN 19 643 dürfen folgende Stoffe verwendet werden:
PH-Wert Senkung
– Salzsäure (HCl)
– Schwefelsäure (H2SO4)
– Kohlenstoffdioxid (CO2)
– Natriumhydrogensulfat (NaHSOC)
PH-Wert Hebung
– Natronlauge (NaOH)
– Natriumcarbonat, bzw Soda (Na2CO3, erhöt Wasserhärte)
– gelegendlich, bei geringer Kalkhaltigkeit auch Calciumhydroxid (Ca(OH) 2, fördert Kalkabscheidung)
Nicht zu verwenden
– Chlorbleichlauge, Natriumhypochlorit (erhöht Chlorgehalt)
– Ammoniakwasser, Ammoniumhydroxid (setzt giftiges Ammoniak frei)
– Phosphorsäure (fördert Algenwachstum)
Messverfahren
Der PH-Wert ist einmal täglich zu bestimmen und in das Betriebshandbuch einzutragen. Der PH-Wert kann kolometrisch, also mit Hilfe von Indikatoren, oder elektrometrisch also mit dem PH-Meter gemessen werden. Seit 2013 muß der PH-Wert laut DIN 19634 elektrometisch bestimmt werden.
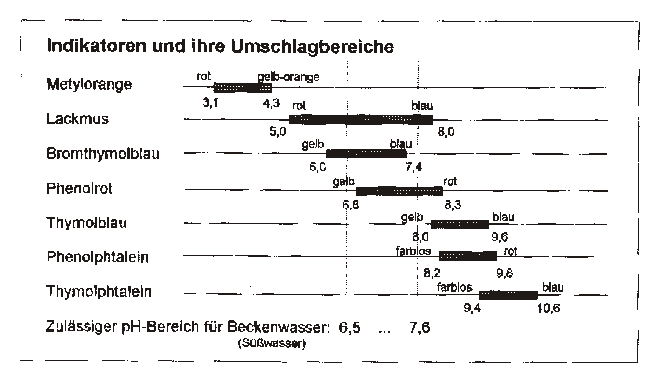
Indikatoren
Indicare itl. = anzeigen
Indikatoren sind schwache Säuren. Im sauren Bereich (undissoziiert) und im alkalischen Bereich (dissoziiert) weisen sie eine andere Farbgebung auf. Der Farbumschlagsbereich ist der Meßbereich des Indikators und zeigt für gewöhnlich eine PH-Wert differenz von 1,2 2,5 an. Ein Indikator funktioniert nur innerhalb seines Umschlagbereiches.
Indikatoren & Umschlagsbereiche
– Metylorange PH 3,1 (rot) bis PH 4,3 (gelb-orange)
– Lackmus PH 5,0 (rot) bis PH 8,0 (blau)
– Bromthymolblau PH 6,0 (gelb) bis PH 7,4 (blau)
– Phenolrot PH 6,8 (gelb) bis PH 8,3 (rot)
– Thymolblau PH 8,0 (gelb) biss PH 9,6 (blau)
– Phenolphtalein PH 8,2 (farblos) bis PH 9,8 (rot)
– Thymolphtalein PH 9,4 (farblos) bis PH 10,6 (blau)
Da der zulässige PH-Bereich für Beckenwasser (süß) im Bereich zwischen 6,5 und 7,6 liegt hat sich hier Phenolrot als optimaler Indikator zur PH-Wert Bestimmung etabliert.
Eine Küvette wird mit 10 ml Beckenwasser gefüllt. Der Indikator wird in flüssiger-, oder Tablettenform in der Küvette gelöst. Die Farbgebung wird mit einer Farbscaler verglichen. Für Schnellmessungen gibt es auch Universalindikatoren. Das sind auf Papierstreifen gelöste Indikatoren, welche in die zu Messende Flüssigkeit getaucht wird. Anschließend wird der Wert an der Farbscaler verglichen. Diese Messung ist zwar schnell und einfach, jedoch auch sehr ungenau.