Salze
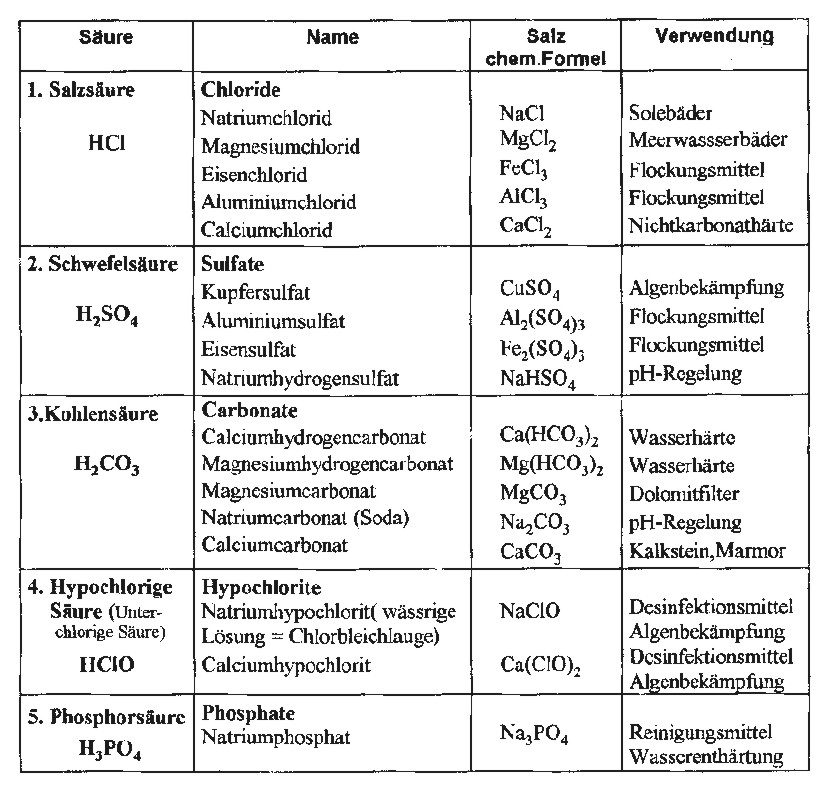
Salzbildung
1. Säure + Base > Salz + Wasser
2. Metall + Nichtmetall > Salz
3. Säure + Metall ( unedel) > Salz + Wasserstoff
4. Säure + Metalloxid > Salz + Wasser
5. Starke Säure + Salz der schwachen Säure > Salz der starken Säure + schwache Säure
Entstehung
1. Säure + Base
Führt man die gleiche Menge gleich konzentrierter Säure und Lauge zusammen, so sind diese neutralisiert, was heißt, dass die Lösung weder sauer noch basisch ist. Bei jeder Neutralisation entsteht Salz und Wasser.
3. Säure + Metall
Säuren greifen unedle Metalle unter Bildung von Wasserstoff und Salz an. Bei dieser Reaktion sind die H+-Ionen mit ihrem entweichen verantwortlich, nicht aber der in Lösung gehende Säurerest. Neben dem entweichende Wasserstoff werden Teile des Metalls in Salz umgewandelt und die restlichen Bestandteile bleiben in Lösung.
Entweichende HCl-Dämpfe (z.B. Öffnen des Behälters) dissoziieren durch in der Luft normalerweise vorhandenen Wasserdampf zu Chlorid- und H+-Ionen. Somit werden Metalle und die Atemwege angegriffen.
5. Säure + Salz
Starke Säuren können den Säureanteil einer schwachen Säure aus der Verbindung des Salzes bringen. Dieser Vorgang läuft im Marmorreaktionsturm ab, wo die starke Säure Salzsäure mit dem Salz der schwachen Säure Calciumcarbonat zu dem Salz der starken Säure Calciumchlorid und zur schwachen Säure Kohlensäure reagiert (2HCl+CaCO3>CaCl2+H2CO3)
2. Metall + Nichtmetall
Aggressive Nichtmetalle können Metalle angreifen, wobei Salz entsteht. Bleidichtungen (Pb+Cl2PbCl2 Bleichlorid, gelb), Kupferleitungen (Cu+Cl2CuCl2 Kupferchlorid, grün) und verzinkte Materialien (Zn+Cl2ZnCl2 Zinkchlorid) werden von Chlorgas (Cl2) unter Salzbildung angegriffen.
4. Säure + Metalloxid
Metalloxide (z.B. Rost) reagieren mit Säuren unter Bildung von Salz und Wasser. Das ist nützlich um Oxidschichten zu beseitigen. Hierzu ist zu beachten, das die Säure nach der Beseitigung gründlich abgespült werden muss.
Aufbau
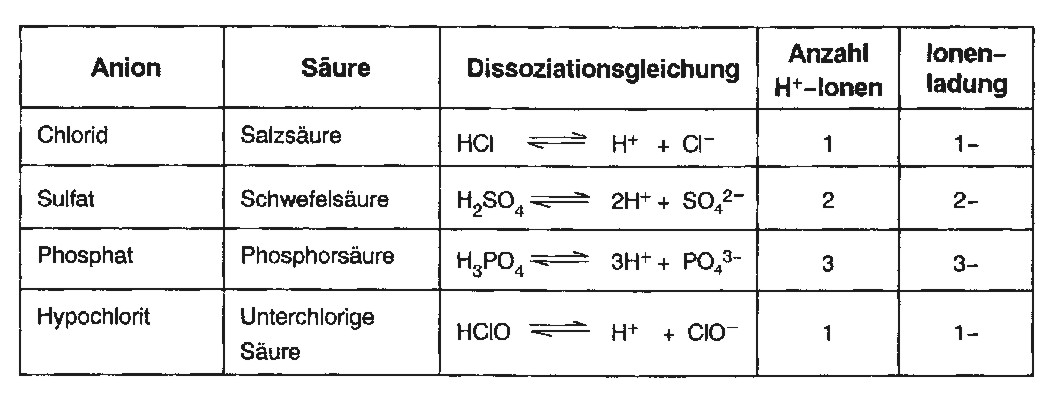
Salze sind Ionenverbindungen. Es handelt sich bei Salzen um positiv geladene Basenreste, oder um negativ geladene Säurereste, die nach Neutralisation verbleiben.
Benennung
Salznamen setzen sich aus dem Namen des Metalls (Basenrest) und des Nichtmetalls (Säurerest) zusammen. Am Ende des Namens wird der Sauerstoff angegeben.
Normaler Sauerstoffgehalt
…at
Sulfat, Phosphat
z.B. Na2SO4 (Natriumsulfat)
geringer Sauerstoffgehalt
…it
Sulfit, Chlorit
z.B. NaClO2 (Natriumchlorit)
sehr geringer Sauerstoffgehalt
…hypo…it
Hypochlorit
z.B. NaClO (Natriumhypochlorit)
Salze der sauerstofffreien Säuren
…id
Sulfid; Chlorid
z.B. NaCl (Natriumchlorid)
Wasserstoffhaltige Salze
…hydrogen…
Hydrogensulfat; hydrogencarbonat
Z.B. NaHCO3 (Natriumhydrogencarbonat)
Salze & PH-Wert
Lösungen von Salzen…
…aus starken Säuren und schwachen Basen
reagieren sauer
…aus schwachen Säuren und starken Basen
reagieren alkalisch
…aus starken Säuren und starken Basen
reagieren neutral
…aus schwachen Säuren und schwachen Basen
reagieren neutral
chemische Formelbildung
Die Summenformel eines Salzes wird bestimmt, indem man die Ionenladungszahl bestimmt (Metallionen/Kationen = positive Ladung = Hauptgruppennummer im PSE
Nichtmetallionen/Anionen = negative Ladung = in der Säure enthaltende H+-Ionen) und so viele Kationen und Anionen miteinander kombiniert, bis die (positive/negative) Ladung ausgeglichen ist.
Element Natrium = 1. Hauptgruppe = Ionen-Ladung +1
Element Magnesium = 2. Hauptgruppe = Ionen-Ladung +2
Element Aluminium = 3. Hauptgruppe = Ionen-Ladung +3
Beispiel:
– Kation = Al
– Anion = So4
– Al steht in der 3. Hauptgruppe (Al3+), SO4 hat in der Schwefelsäure (H2SO4) 2 H+-Ionen (So42-)
– Ladungsausgleich: 2 Al3+ + 3 SO42- > Al2(SO4)3