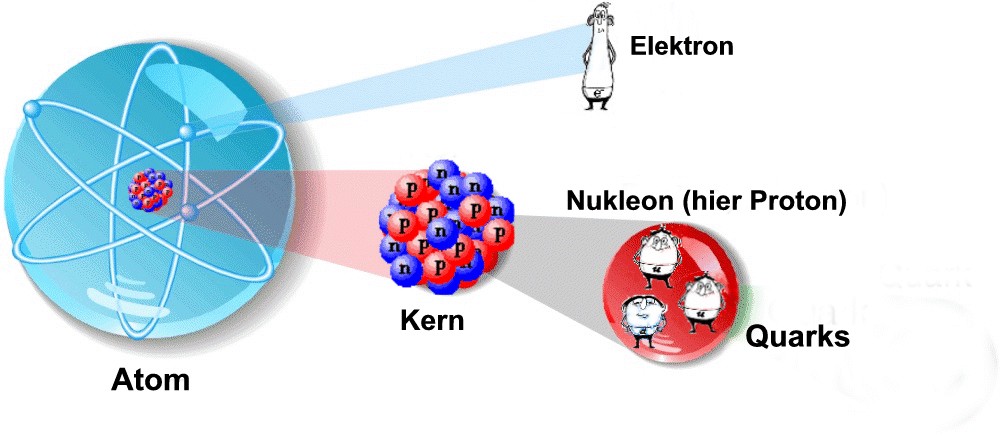
das Atom
Aufbau
1) Kern
– der Kern besteht aus Nukleonen, zum einen Protonen (+) und Neutronen (o)
2) Hülle
– die Hülle besteht aus Elektronen (-)
3) Beispiel Helium
– die Anzahl der Elektronen ist mit der, der Protonen gleichzusetzen
– ein Helium Atom hat 2 Elektronen auf der Außenschale und somit 2 Protonen
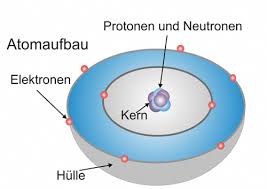
Grundlagen
– Atomkerne aller Elemente bestehen aus den gleichen Nukleonen
– Die Masse des Atoms wird durch die Anzahl der Nukleonen bestimmt, diese ist jedoch im Verhältnis
zu den Elektronen verschwindend
– Die Ladungen der Protonen im Kern und die der Elektronen der Hülle gleichen sich aus
– Atome sind nach außen hin neutral
– Die Anzahl der Protonen eines Elementes sind immer gleich, die Anzahl der Neutronen kann jedoch
variieren
– Es gibt somit Atome eines Elementes mit unterschiedlicher Maßen/Gewicht
Atomhülle
1) Energienevau
– Energienevau = Periode
– 1,2,3,4,5,6, 7, oder K,L,M,N,O,P,Q
– Elektronen werden den Energienevaus zugeordnet
– Wir benutzen das Schalenmodell zur Vorstellung
– Kernnähere Elektronen sind energieärmer
– Innerhalb der Perioden gibt es Energieunterschiede zwischen den Elektronen
– S-orbital (2 Elektronen) und p-orbital (6 Elektronen)
2) Edelgaskonfiguration
Auch Zwischenabsättigung, oder Elektronenoktett. Die volle Besetzung der s-orbitalen und der porbitalen
erweist sich als besonders stabile Zwischenabsättigung der äußeren Schale. Alle Edelgase (8.
Hauptgruppe) weisen diesen Zustand auf, welches sie hemmt chemische Bindungen einzugehen. Die
Anzahl der Valenzelektronen (Außenelektronen) bestimmt mit Ihrem Energiepotential weitgehend die
chemischen Eigenschaften des Atoms und somit auch die des Elementes.
3) Elektrohnenberechnung
Um die maximale Anzahl an Elektronen der genannten Periode (Schale) zu berechnen, muss man
diese quadrieren und mit dem Multiplikator 2 nehmen. Die Periode wird mit dem Synonym „n“
dargestellt. Auf der äußeren Periode lagern maximal 8 Elektronen (mit dem neunten wird die
vorherige Schale aufgefüllt).
2 * n²
Möchte man die Anzahl der Neutronen herausfinden, so bildet man die Differenz zwischen der Massen
und der Ordnungszahl.